

自己寛容の破綻:自己免疫におけるT細胞による「セルフ」と「ネオセルフ」の識別
CD4 T細胞による「セルフ」と「ネオセルフ」の識別:自己免疫疾患の新しい概念
自己免疫疾患は、HLA(MHC)クラスIIアリルの遺伝型と強く関連していますが、リスクアリルを持つ人のほとんどは発症しません。このことは、遺伝的要因だけでは不十分であり、自己免疫疾患の発症には抗原提示における質的な変化が関与していることを示唆しています。私たちの研究は、従来の「セルフ vs ノンセルフ(self versus nonself)」モデルから、「セルフ vs ネオセルフ(self versus neoself)」の識別モデルへの概念転換に焦点を当てています。このモデルでは、MHCクラスIIへの抗原提示経路の変化によって提示された異常な自己抗原(ネオセルフ)をCD4 T細胞が異物として認識して病的な反応を引き起こします。
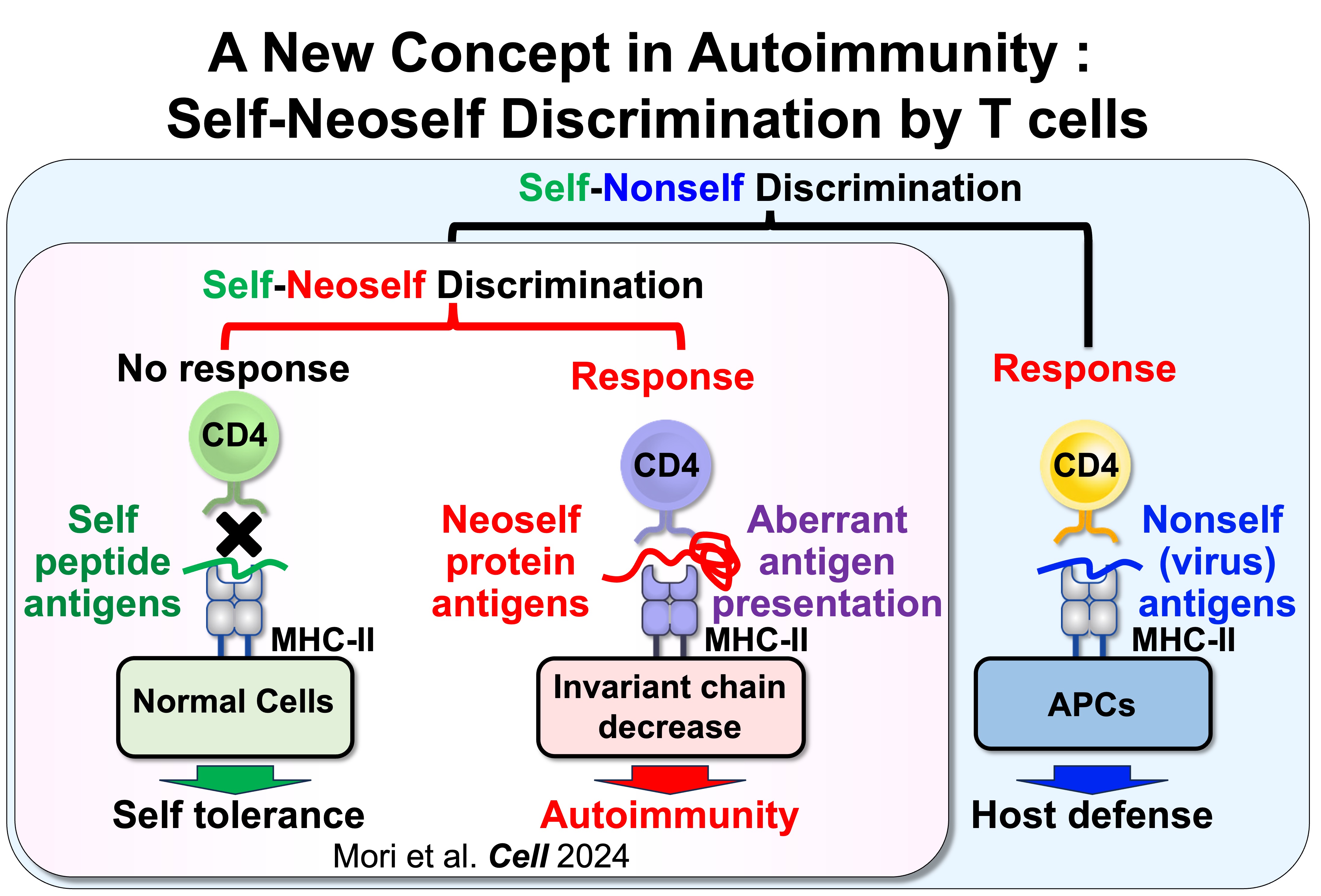
図1:セルフ-ノンセルフの識別 vs セルフ-ネオセルフの識別
我々は、正常の状態(インバリアント鎖が正常に発現している状態)でMHCクラスII上に提示される自己抗原の「セルフペプチド」と、インバリアント鎖の発現が低下した際に異常に提示される自己抗原を、CD4 T細胞が識別できることを見出しました。インバリアント鎖の発現が低下することで提示される自己抗原は、通常のMHCクラスII上のものとは著しく異なるため、我々はこれらを「ネオセルフ抗原」と命名しました。特筆すべきことに、ネオセルフ抗原の提示が誘導されると、ネオセルフ反応性T細胞のクローナルな増殖が起こり、自己免疫疾患が誘発されます。さらに、全身性エリテマトーデス(SLE)患者の体内でも、これらのネオセルフ反応性T細胞がクローナルに増殖していることが確認されました。これらの知見は、ネオセルフ抗原の異常な提示が自己免疫疾患の病態形成において極めて重要な役割を果たしていることを示唆しています。
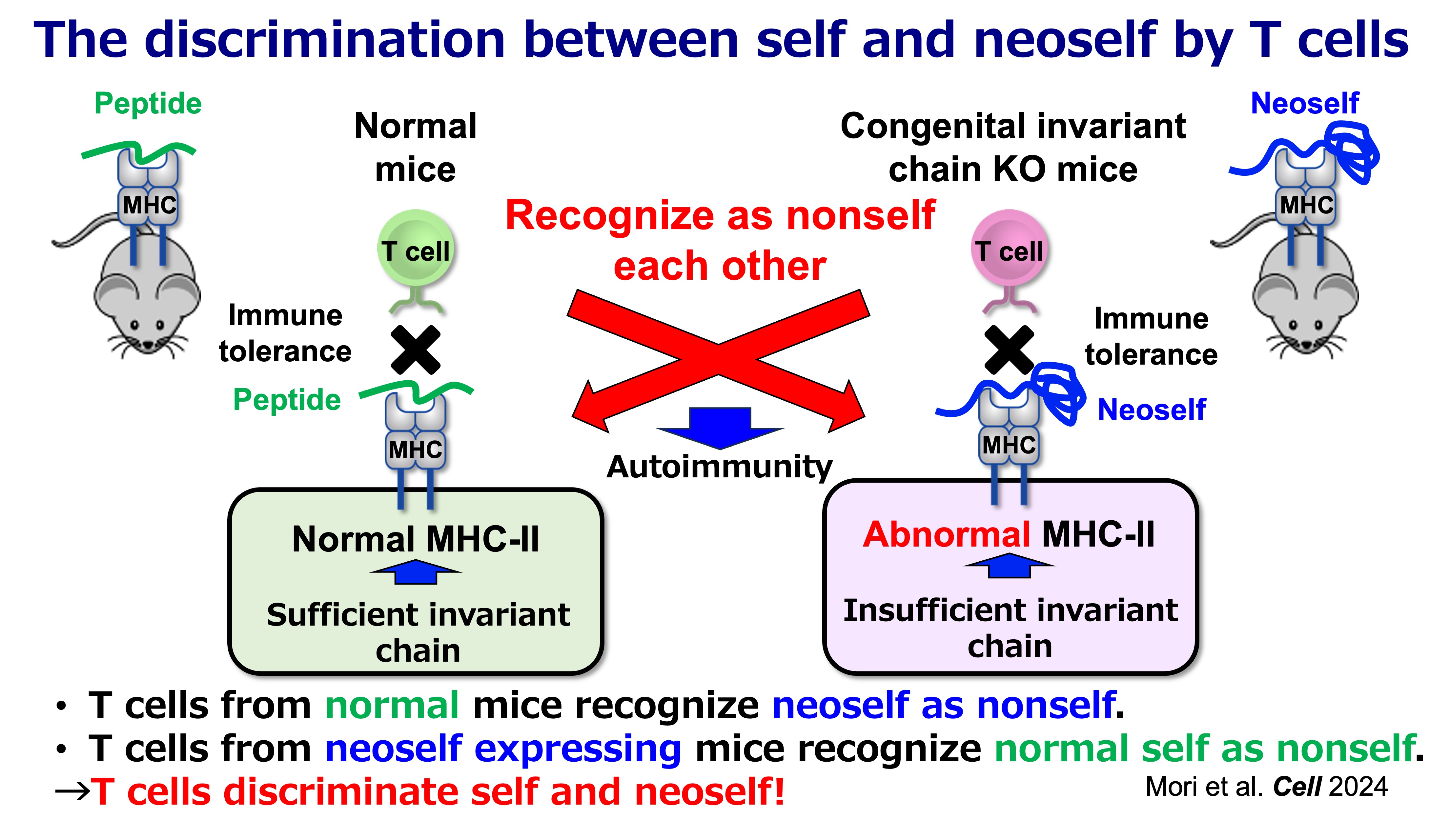
図2:T細胞によるセルフとネオセルフの識別
「ネオセルフ」とは何か?
通常の抗原提示経路では、MHCクラスII分子はエンドソーム/リソソーム画分で生成されたペプチド断片を提示します。この経路の鍵となるのがインバリアント鎖です。インバリアント鎖は、(i) MHCクラスIIを適切な抗原提示経路へと誘導し、(ii) 小胞体内でペプチド結合溝に不適切なタンパク質が結合するのを防ぐ役割を担っています。この正常な経路において、提示される自己抗原のレパートリーは主にリソゾームで分解された「ペプチド」です。
しかし、インバリアント鎖の発現が低下または阻害されると、MHCクラスII分子は質的に異なる自己抗原、すなわち小胞体内の内在性タンパク質の非構造領域と結合します。これらの複合体は、通常のエンドソームでのプロセシングを経ずに細胞表面へと運ばれます。私たちは、この特異な抗原提示形態を「ネオセルフ提示」と呼んでいます。重要なのは、ここでの「ネオセルフ」は癌細胞にみられるような遺伝子変異由来のネオアンチゲンではないということです。つまり、正常な自己分子がMHCクラスII分子に提示される際、その経路により免疫学的に異なる抗原性を獲得することを意味します。
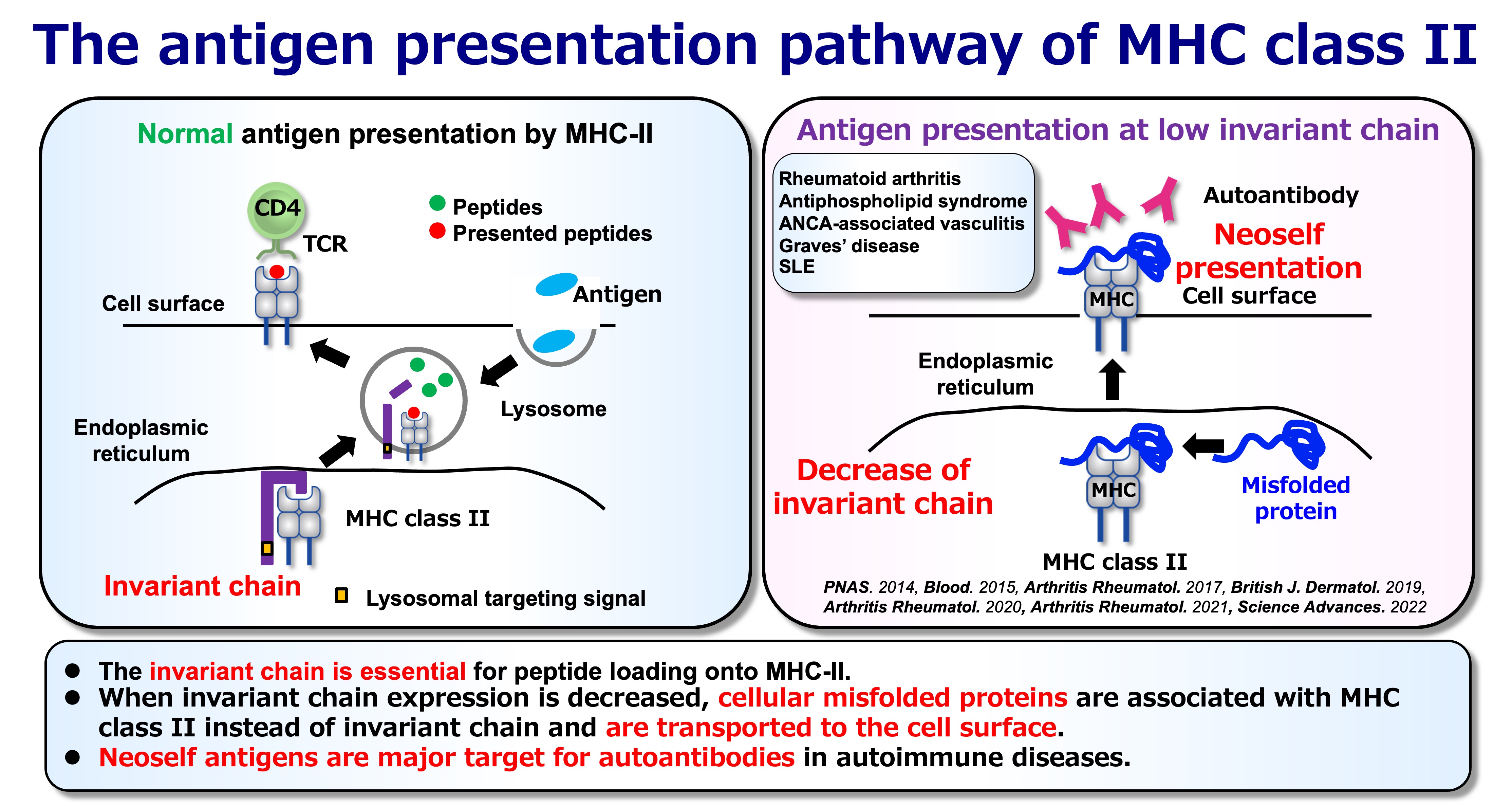
図3:正常および異常な抗原提示
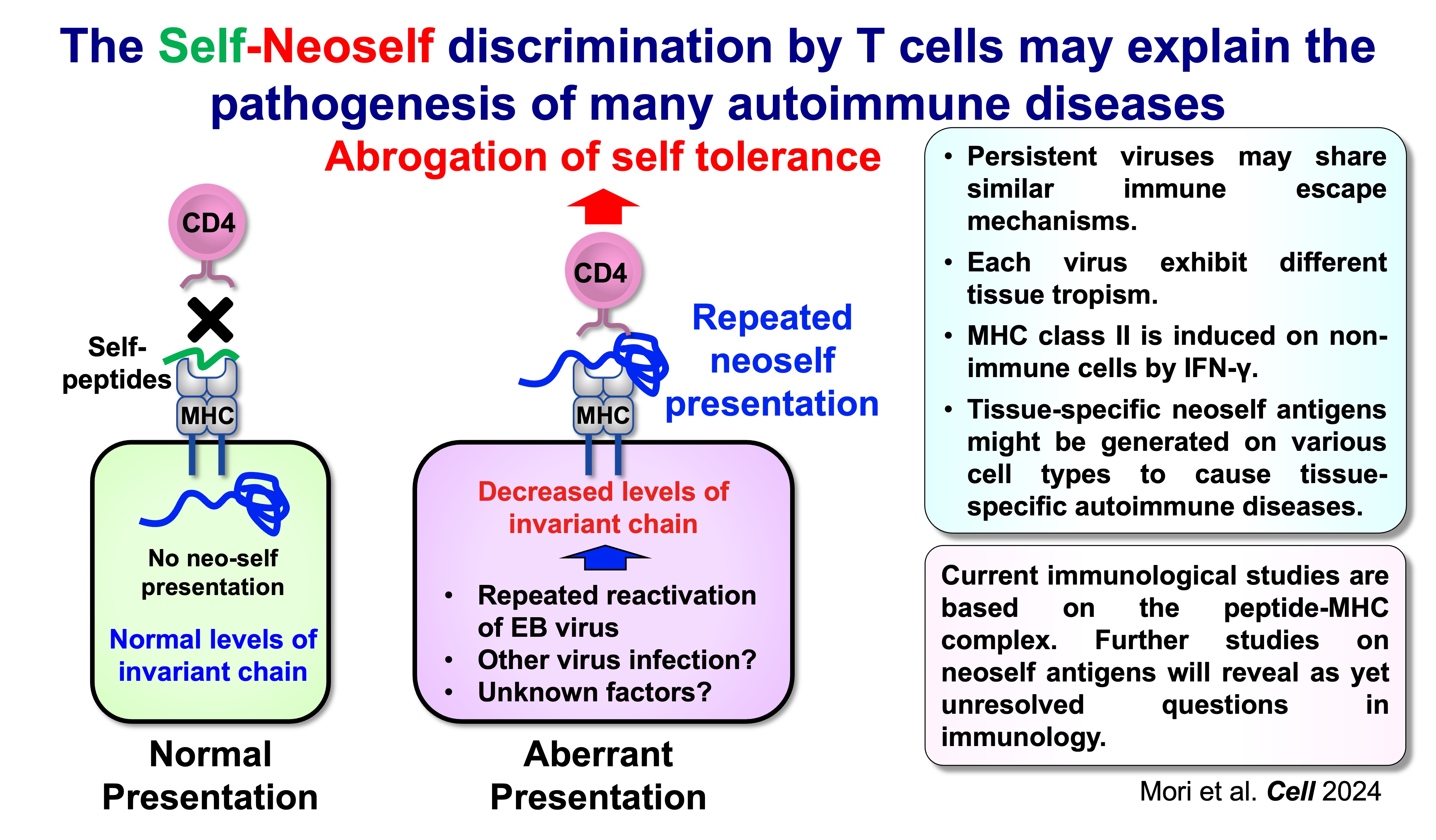
なぜネオセルフ抗原提示が免疫寛容の破綻を引き起こすのか?
ネオセルフ提示の重要な点は、免疫システムにおける「セルフ」の定義が、単に分子のアミノ酸配列だけでなく、抗原がどのようにプロセシングされ提示されるかによっても決定されるという点です。正常な状態、つまり、インバリアント鎖が十分存在し、通常の自己抗原ペプチドが提示されている状況では、T細胞はそのような自己抗原ペプチドに対してのみ免疫寛容になっており、ネオセルフには免疫寛容になっていません。そのため、後天的にネオセルフが提示されると、免疫寛容になっていないネオセルフを、T細胞が免疫学的な「ノンセルフ(外来物)」として認識してしまうのです。
このことは、成熟マウスからインバリアント鎖を除去できる誘導型遺伝子改変マウスモデルによって裏付けられています。このモデルでは、ネオセルフ提示の出現に伴い、強力なCD4 T細胞の活性化、濾胞性ヘルパーT細胞(Tfh)の増加、胚中心の拡大、そして広範な自己抗体産生と免疫複合体による病理像(全身性エリテマトーデス(SLE)に類似した特徴)が観察されます。対照的に、生まれつきインバリアント鎖が欠損している場合、ネオセルフに対して免疫寛容になりますが、正常の自己抗原ペプチドには免疫寛容になりません。以上の実験結果は、「CD4 T細胞は『セルフ』と『ネオセルフ』を識別でき、その区別が自己免疫発症の決定要因になり得る」ということを示しております。
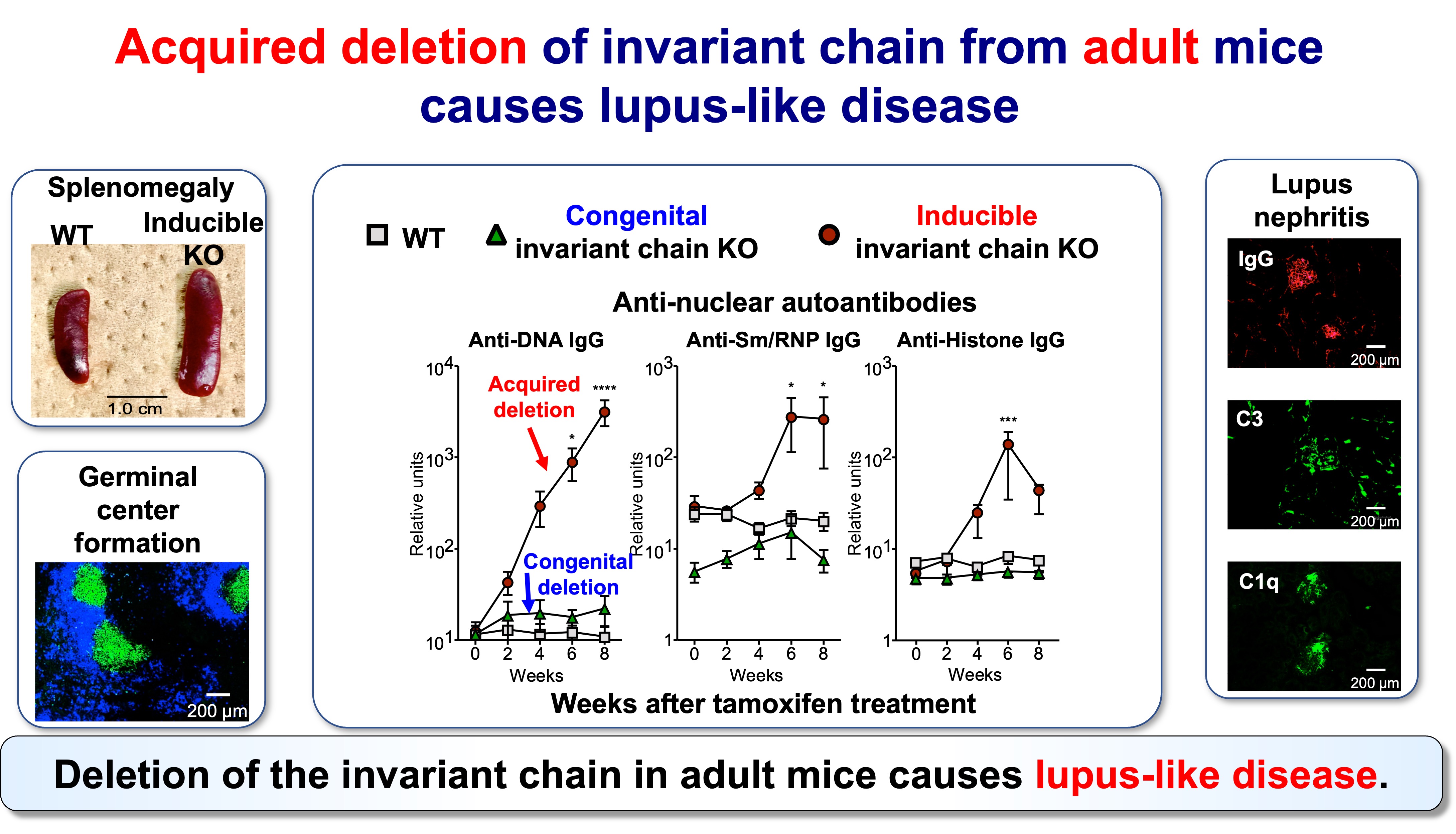
図4:後天的なインバリアント鎖欠損マウスにおけるループス様疾患の発症
ループス様疾患の原動力としてのネオセルフ反応性CD4 T細胞
ネオセルフの提示は、CD4 T細胞がどのように全身性自己免疫を引き起こすかを示しています。ネオセルフに反応するCD4 T細胞がクローン性に増殖すると、Tfh様の性質を獲得してB細胞を強力に活性化し、胚中心反応を促進します。その結果、自己抗体応答が拡大・多様化し、病態が自己増幅的に進行します。TCR特異性の機能解析からも、ネオセルフ反応性クローンは単なる付随的な現象ではなく、異常な抗原提示によって活性化され病態増悪に直接関与しうることが明らかになりました。
このネオセルフモデルは、様々な自己免疫疾患に認められる免疫学的な異常とも整合します。多くの自己免疫疾患で見られる病的自己抗体は、単一の通常自己抗原というより、“通常とは異なる自己抗原の状態”を認識している可能性があり、MHCクラスIIを含む分子複合体が標的となる例も明らかになっています。したがってネオセルフは、特定の分子に限定されるものではなく、抗原提示が異常になった際の自己抗原の「提示状態」と考えられます。
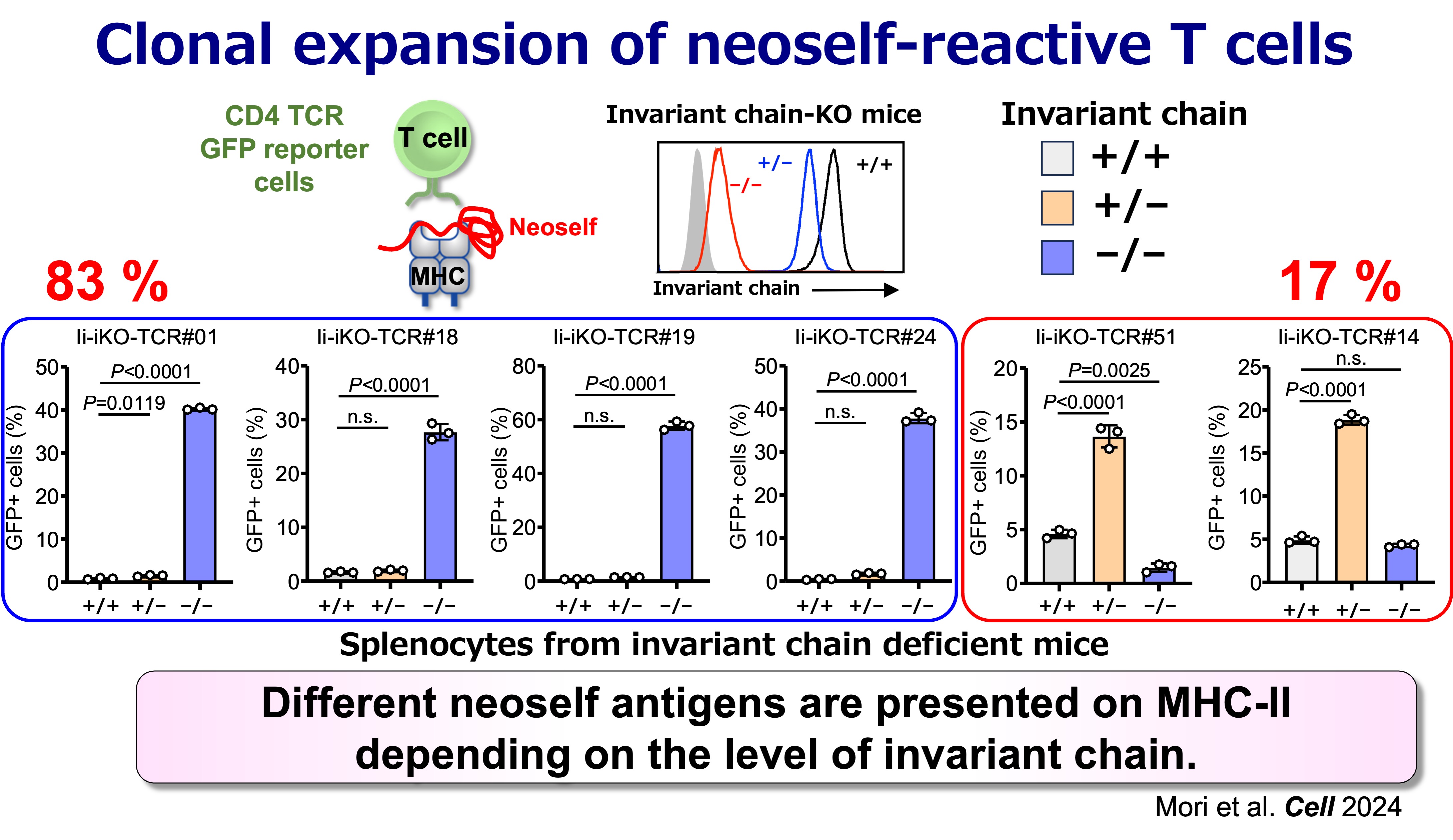
図5:ネオセルフ反応性T細胞の抗原特異性
ヒトSLEにおける重要性
臨床における中心的な問いは、ヒトの疾患においてもネオセルフ反応性CD4 T細胞が増殖しているかという点です。患者由来のTCR解析の結果、SLEにおいてクローナルに増殖しているCD4 T細胞には、かなりの割合でネオセルフ反応性コンポーネントが含まれていることが判明しました。これは、確立した病態においてネオセルフ抗原が主要な免疫標的となり得るという考えを裏付けるものです。この知見は、臨床的に意義のあるTCRシグネチャや抗原提示状態を特定し、患者ごとの疾患メカニズムを層別化する道を開くものです。
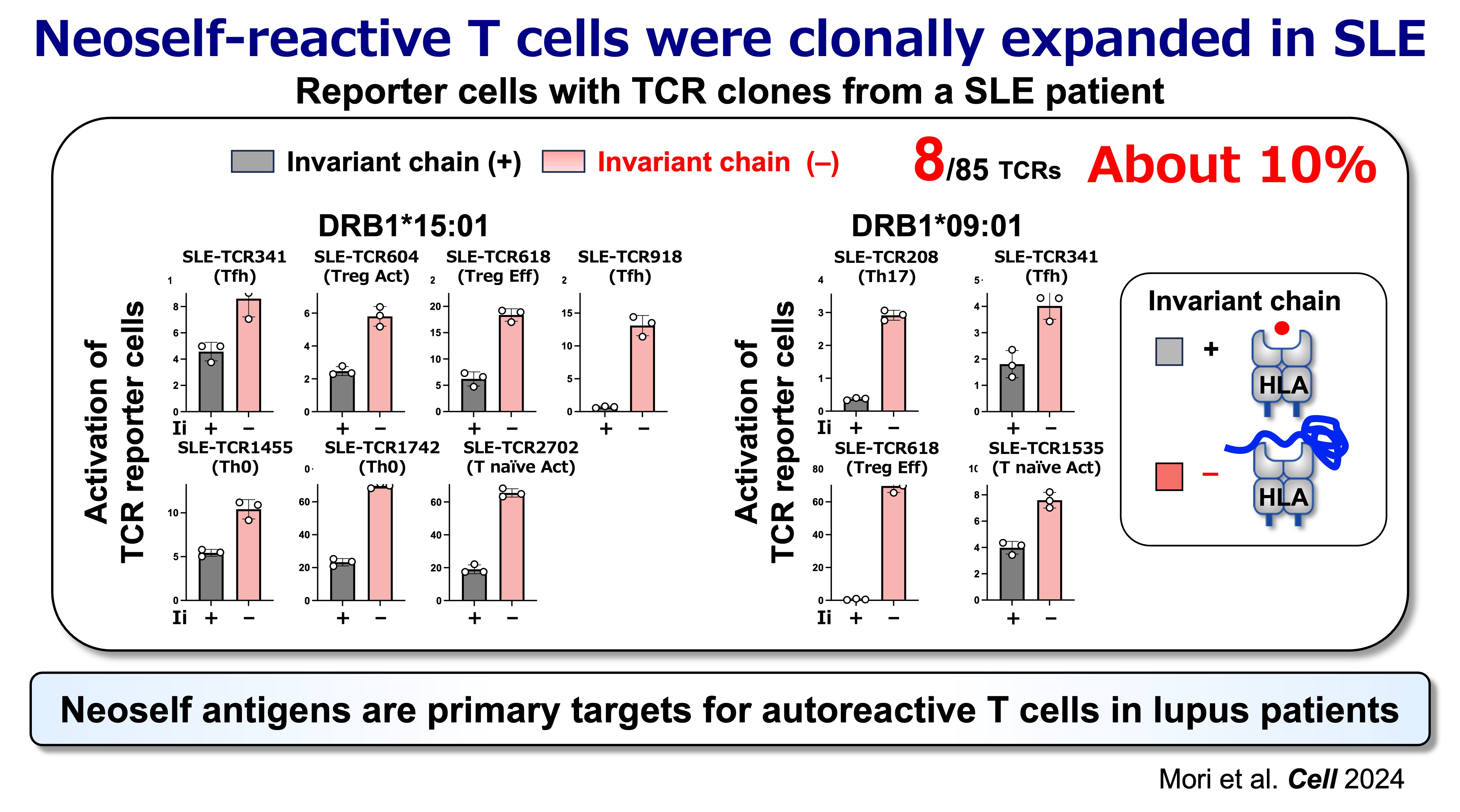
図6:ネオセルフ抗原はループス患者における自己反応性T細胞の主要な標的である
環境要因:持続性ウイルス感染と抗原提示の変化の結びつき
自己免疫疾患は環境因子の攪乱に続いて発症することが多く、持続性ヘルペスウイルスはSLE病態形成における有力な候補となっています。特に説得力のある関連性はエプスタイン・バーウイルス(EBV)の再活性化です。EBVの再活性化は、インバリアント鎖を含むMHCクラスII経路の構成要素をダウンレギュレートし、それによって抗原提示をネオセルフへとシフトさせます。この観点では、ウイルスの免疫逃避機構は単に自己免疫リスクと相関しているだけでなく、ネオセルフ反応性CD4 T細胞の出現と増殖を許容する抗原提示状態を直接的に誘導していると考えられます。
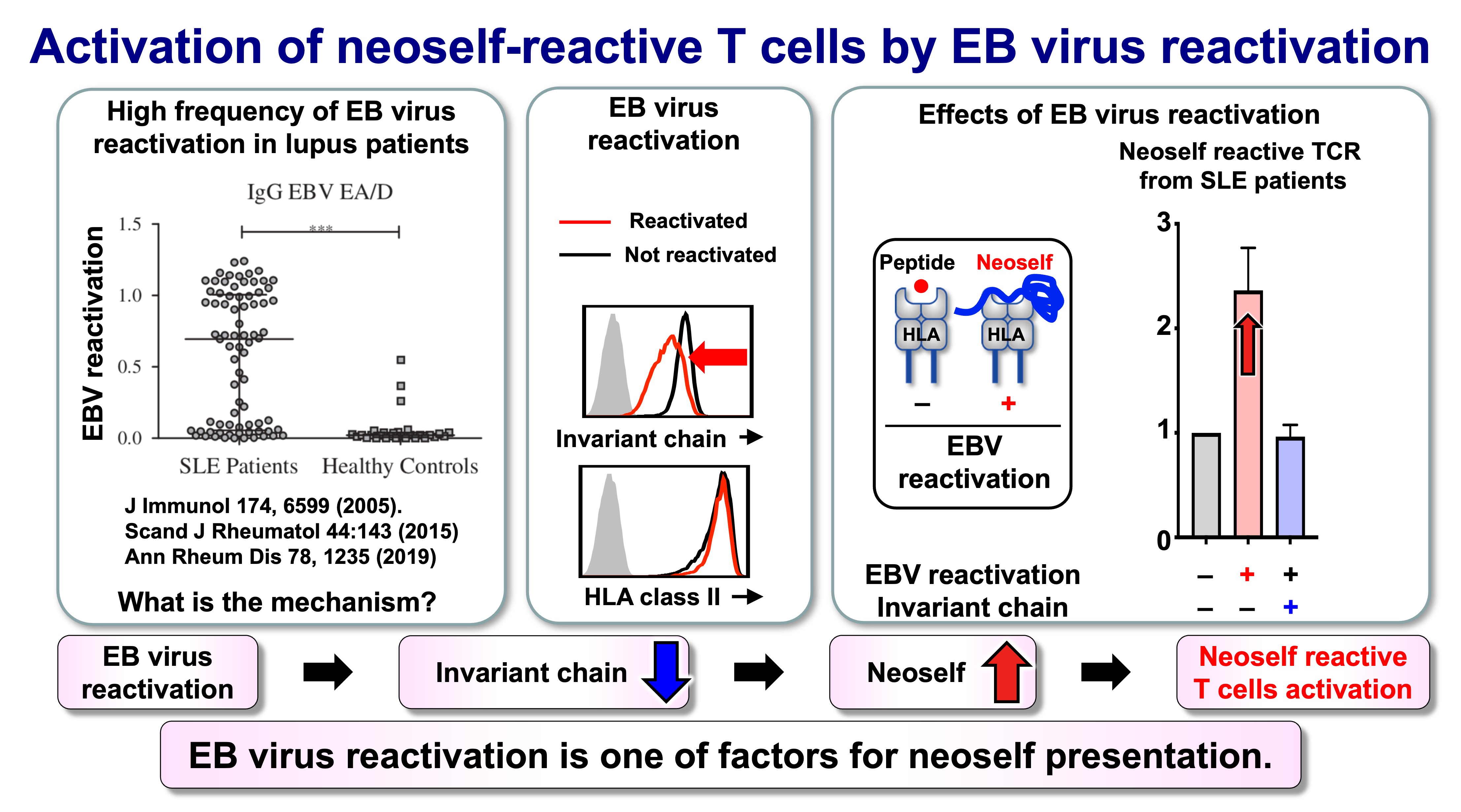
図7:EBウイルス再活性化によるネオセルフ反応性T細胞の活性化
展望:メカニズムに基づいた診断と介入に向けて
「セルフ-ネオセルフ識別モデル」は、基礎研究と臨床応用の両面で新しい可能性を提示しています。基礎研究の側面では、(i) どの抗原提示細胞(APC)が最も効率的にネオセルフを生成するのか、(ii) 疾患リスクの高いHLAクラスIIアレルがネオセルフの結合やトラフィッキングにどのように影響するのか、(iii) どのようなTCRの特徴が病的なネオセルフ認識を予測するのか、を明らかにすることを目指しています。臨床応用の側面では、ネオセルフ反応性TCRや抗原ロードの異常を示すマーカーが診断指標となり得るほか、標準的な抗原ロード経路を回復または安定化させることが、免疫全体を広く抑制することなく疾患の発症メカニズムを標的とした選択的な治療戦略となる可能性があります。
関連論文
Mori S, Kohyama M, Yasumizu Y, Tada A, Tanzawa K, Shishido T, Kishida K, Jin H, Nishide M, Kawada S, Motooka D, Okuzaki D, Naito R, Nakai W, Kanda T, Murata T, Terao C, Ohmura K, Arase N, Kurosaki T, Fujimoto M, Suenaga T, Kumanogo A, Sakaguchi S, Ogawa Y, Arase H
Neoself-antigens are the primary target for autoreactive T cells in human lupus
Cell 2024 187: 6071-6087 [ Link ] [AI Podcast]
Jin H, Kishida K, Arase N, Matsuoka S, Nakai W, Kohyama M, Suenaga T, Yamamoto K, Sasazuki T, Arase H
Abrogation of self-tolerance by misfolded self-antigens complexed with MHC class II molecules.
Science Advances 2022. 8:eabj9867 [ Link ]
Tsuji, H, Ohmura, K, Jin, H, Naito, R, Arase, N, Kohyama, K, Suenaga, T, Sakakibara, S, Kochi, Y, Okada, Y, Yamamoto, K, Kikutani, H, Morinobu, A, Mimori, T, Arase H
Anti-dsDNA antibodies recognize DNA presented on HLA class II molecules of systemic lupus erythematosus risk alleles.
Arthritis Rheumatol 2022 74:105-111.[ Link ]
Hiwa R, Ohmura K, Arase N, Jin H, Hirayasu K, Kohyama M, Suenaga T, Saito F , Terao C, Atsumi T, Iwatani H, Mimori T, Arase H.
Myeloperoxidase/HLA class II complexes recognized by autoantibodies in microscopic polyangiitis.
Arthritis Rheumatol. 2017 69:2069-2080. [ Link]
Tanimura K, Jin, H, Suenaga T, Morikami S, Arase N, Kishida K, Hirayasu K, Kohyama, M. , Ebina Y, Yasuda S, Horita T, Takasugi K, Ohmura K, Yamamoto K, Katayama I, Sasazuki T, Lanier LL, Atsumi T, Yamada, H. Arase H 2015. β2-glycoprotein I / HLA class II complexes are novel autoantigens in antiphospholipid syndrome.
Blood. 125: 2835-2844. [ Link]
Jin H, Arase N, Hirayasu K, Kohyama M, Suenaga T, Saito F, Tanimura K, Matsuoka, S. , Ebina K, Shi K, Toyama-Sorimachi N, Yasuda S, Horita T, Hiwa R, Takasugi K, Ohmura K, Yoshikawa H, Saito T, Atsumi T, Sasazuki T, Katayama I, Lanier LL, Arase H 2014. Autoantibodies to IgG/HLA class II complexes are associated with rheumatoid arthritis susceptibility.
Proc. Natl. Acad. Sci. USA. 111: 3787-3792. [ Link]
Jiang Y, Arase N, Kohyama M, Hirayasu K, Suenaga T, Jin H, Matsumoto M, Shida K, L. Lanier LL, Saito T, Arase H 2013. Transport of misfolded endoplasmic reticulum proteins to the cell surface by MHC class II molecules.
Int. Immunol. 25:235-246. [ Link]


自己寛容の破綻:自己免疫におけるT細胞による「セルフ」と「ネオセルフ」の識別
CD4 T細胞による「セルフ」と「ネオセルフ」の識別:自己免疫疾患の新しい概念
自己免疫疾患は、HLA(MHC)クラスIIアリルの遺伝型と強く関連していますが、リスクアリルを持つ人のほとんどは発症しません。このことは、遺伝的要因だけでは不十分であり、自己免疫疾患の発症には抗原提示における質的な変化が関与していることを示唆しています。私たちの研究は、従来の「セルフ vs ノンセルフ(self versus nonself)」モデルから、「セルフ vs ネオセルフ(self versus neoself)」の識別モデルへの概念転換に焦点を当てています。このモデルでは、MHCクラスIIへの抗原提示経路の変化によって提示された異常な自己抗原(ネオセルフ)をCD4 T細胞が異物として認識して病的な反応を引き起こします。

図1:セルフ-ノンセルフの識別 vs セルフ-ネオセルフの識別
我々は、正常の状態(インバリアント鎖が正常に発現している状態)でMHCクラスII上に提示される自己抗原の「セルフペプチド」と、インバリアント鎖の発現が低下した際に異常に提示される自己抗原を、CD4 T細胞が識別できることを見出しました。インバリアント鎖の発現が低下することで提示される自己抗原は、通常のMHCクラスII上のものとは著しく異なるため、我々はこれらを「ネオセルフ抗原」と命名しました。特筆すべきことに、ネオセルフ抗原の提示が誘導されると、ネオセルフ反応性T細胞のクローナルな増殖が起こり、自己免疫疾患が誘発されます。さらに、全身性エリテマトーデス(SLE)患者の体内でも、これらのネオセルフ反応性T細胞がクローナルに増殖していることが確認されました。これらの知見は、ネオセルフ抗原の異常な提示が自己免疫疾患の病態形成において極めて重要な役割を果たしていることを示唆しています。

図2:T細胞によるセルフとネオセルフの識別
「ネオセルフ」とは何か?
通常の抗原提示経路では、MHCクラスII分子はエンドソーム/リソソーム画分で生成されたペプチド断片を提示します。この経路の鍵となるのがインバリアント鎖です。インバリアント鎖は、(i) MHCクラスIIを適切な抗原提示経路へと誘導し、(ii) 小胞体内でペプチド結合溝に不適切なタンパク質が結合するのを防ぐ役割を担っています。この正常な経路において、提示される自己抗原のレパートリーは主にリソゾームで分解された「ペプチド」です。
しかし、インバリアント鎖の発現が低下または阻害されると、MHCクラスII分子は質的に異なる自己抗原、すなわち小胞体内の内在性タンパク質の非構造領域と結合します。これらの複合体は、通常のエンドソームでのプロセシングを経ずに細胞表面へと運ばれます。私たちは、この特異な抗原提示形態を「ネオセルフ提示」と呼んでいます。重要なのは、ここでの「ネオセルフ」は癌細胞にみられるような遺伝子変異由来のネオアンチゲンではないということです。つまり、正常な自己分子がMHCクラスII分子に提示される際、その経路により免疫学的に異なる抗原性を獲得することを意味します。

図3:正常および異常な抗原提示
なぜネオセルフ抗原提示が免疫寛容の破綻を引き起こすのか?
ネオセルフ提示の重要な点は、免疫システムにおける「セルフ」の定義が、単に分子のアミノ酸配列だけでなく、抗原がどのようにプロセシングされ提示されるかによっても決定されるという点です。正常な状態、つまり、インバリアント鎖が十分存在し、通常の自己抗原ペプチドが提示されている状況では、T細胞はそのような自己抗原ペプチドに対してのみ免疫寛容になっており、ネオセルフには免疫寛容になっていません。そのため、後天的にネオセルフが提示されると、免疫寛容になっていないネオセルフを、T細胞が免疫学的な「ノンセルフ(外来物)」として認識してしまうのです。
このことは、成熟マウスからインバリアント鎖を除去できる誘導型遺伝子改変マウスモデルによって裏付けられています。このモデルでは、ネオセルフ提示の出現に伴い、強力なCD4 T細胞の活性化、濾胞性ヘルパーT細胞(Tfh)の増加、胚中心の拡大、そして広範な自己抗体産生と免疫複合体による病理像(全身性エリテマトーデス(SLE)に類似した特徴)が観察されます。対照的に、生まれつきインバリアント鎖が欠損している場合、ネオセルフに対して免疫寛容になりますが、正常の自己抗原ペプチドには免疫寛容になりません。以上の実験結果は、「CD4 T細胞は『セルフ』と『ネオセルフ』を識別でき、その区別が自己免疫発症の決定要因になり得る」ということを示しております。

図4:後天的なインバリアント鎖欠損マウスにおけるループス様疾患の発症
ループス様疾患の原動力としてのネオセルフ反応性CD4 T細胞
ネオセルフの提示は、CD4 T細胞がどのように全身性自己免疫を引き起こすかを示しています。ネオセルフに反応するCD4 T細胞がクローン性に増殖すると、Tfh様の性質を獲得してB細胞を強力に活性化し、胚中心反応を促進します。その結果、自己抗体応答が拡大・多様化し、病態が自己増幅的に進行します。TCR特異性の機能解析からも、ネオセルフ反応性クローンは単なる付随的な現象ではなく、異常な抗原提示によって活性化され病態増悪に直接関与しうることが明らかになりました。
このネオセルフモデルは、様々な自己免疫疾患に認められる免疫学的な異常とも整合します。多くの自己免疫疾患で見られる病的自己抗体は、単一の通常自己抗原というより、“通常とは異なる自己抗原の状態”を認識している可能性があり、MHCクラスIIを含む分子複合体が標的となる例も明らかになっています。したがってネオセルフは、特定の分子に限定されるものではなく、抗原提示が異常になった際の自己抗原の「提示状態」と考えられます。

図5:ネオセルフ反応性T細胞の抗原特異性
ヒトSLEにおける重要性
臨床における中心的な問いは、ヒトの疾患においてもネオセルフ反応性CD4 T細胞が増殖しているかという点です。患者由来のTCR解析の結果、SLEにおいてクローナルに増殖しているCD4 T細胞には、かなりの割合でネオセルフ反応性コンポーネントが含まれていることが判明しました。これは、確立した病態においてネオセルフ抗原が主要な免疫標的となり得るという考えを裏付けるものです。この知見は、臨床的に意義のあるTCRシグネチャや抗原提示状態を特定し、患者ごとの疾患メカニズムを層別化する道を開くものです。

図6:ネオセルフ抗原はループス患者における自己反応性T細胞の主要な標的である
環境要因:持続性ウイルス感染と抗原提示の変化の結びつき
自己免疫疾患は環境因子の攪乱に続いて発症することが多く、持続性ヘルペスウイルスはSLE病態形成における有力な候補となっています。特に説得力のある関連性はエプスタイン・バーウイルス(EBV)の再活性化です。EBVの再活性化は、インバリアント鎖を含むMHCクラスII経路の構成要素をダウンレギュレートし、それによって抗原提示をネオセルフへとシフトさせます。この観点では、ウイルスの免疫逃避機構は単に自己免疫リスクと相関しているだけでなく、ネオセルフ反応性CD4 T細胞の出現と増殖を許容する抗原提示状態を直接的に誘導していると考えられます。

図7:EBウイルス再活性化によるネオセルフ反応性T細胞の活性化
展望:メカニズムに基づいた診断と介入に向けて
「セルフ-ネオセルフ識別モデル」は、基礎研究と臨床応用の両面で新しい可能性を提示しています。基礎研究の側面では、(i) どの抗原提示細胞(APC)が最も効率的にネオセルフを生成するのか、(ii) 疾患リスクの高いHLAクラスIIアレルがネオセルフの結合やトラフィッキングにどのように影響するのか、(iii) どのようなTCRの特徴が病的なネオセルフ認識を予測するのか、を明らかにすることを目指しています。臨床応用の側面では、ネオセルフ反応性TCRや抗原ロードの異常を示すマーカーが診断指標となり得るほか、標準的な抗原ロード経路を回復または安定化させることが、免疫全体を広く抑制することなく疾患の発症メカニズムを標的とした選択的な治療戦略となる可能性があります。

関連論文
Mori S, Kohyama M, Yasumizu Y, Tada A, Tanzawa K, Shishido T, Kishida K, Jin H, Nishide M, Kawada S, Motooka D, Okuzaki D, Naito R, Nakai W, Kanda T, Murata T, Terao C, Ohmura K, Arase N, Kurosaki T, Fujimoto M, Suenaga T, Kumanogo A, Sakaguchi S, Ogawa Y, Arase H
Neoself-antigens are the primary target for autoreactive T cells in human lupus
Cell 2024 187: 6071-6087 [ Link ] [AI Podcast]
Jin H, Kishida K, Arase N, Matsuoka S, Nakai W, Kohyama M, Suenaga T, Yamamoto K, Sasazuki T, Arase H
Abrogation of self-tolerance by misfolded self-antigens complexed with MHC class II molecules.
Science Advances 2022. 8:eabj9867 [ Link ]
Tsuji, H, Ohmura, K, Jin, H, Naito, R, Arase, N, Kohyama, K, Suenaga, T, Sakakibara, S, Kochi, Y, Okada, Y, Yamamoto, K, Kikutani, H, Morinobu, A, Mimori, T, Arase H
Anti-dsDNA antibodies recognize DNA presented on HLA class II molecules of systemic lupus erythematosus risk alleles.
Arthritis Rheumatol 2022 74:105-111.[ Link ]
Hiwa R, Ohmura K, Arase N, Jin H, Hirayasu K, Kohyama M, Suenaga T, Saito F , Terao C, Atsumi T, Iwatani H, Mimori T, Arase H.
Myeloperoxidase/HLA class II complexes recognized by autoantibodies in microscopic polyangiitis.
Arthritis Rheumatol. 2017 69:2069-2080. [ Link]
Tanimura K, Jin, H, Suenaga T, Morikami S, Arase N, Kishida K, Hirayasu K, Kohyama, M. , Ebina Y, Yasuda S, Horita T, Takasugi K, Ohmura K, Yamamoto K, Katayama I, Sasazuki T, Lanier LL, Atsumi T, Yamada, H. Arase H 2015. β2-glycoprotein I / HLA class II complexes are novel autoantigens in antiphospholipid syndrome.
Blood. 125: 2835-2844. [ Link]
Jin H, Arase N, Hirayasu K, Kohyama M, Suenaga T, Saito F, Tanimura K, Matsuoka, S. , Ebina K, Shi K, Toyama-Sorimachi N, Yasuda S, Horita T, Hiwa R, Takasugi K, Ohmura K, Yoshikawa H, Saito T, Atsumi T, Sasazuki T, Katayama I, Lanier LL, Arase H 2014. Autoantibodies to IgG/HLA class II complexes are associated with rheumatoid arthritis susceptibility.
Proc. Natl. Acad. Sci. USA. 111: 3787-3792. [ Link]
Jiang Y, Arase N, Kohyama M, Hirayasu K, Suenaga T, Jin H, Matsumoto M, Shida K, L. Lanier LL, Saito T, Arase H 2013. Transport of misfolded endoplasmic reticulum proteins to the cell surface by MHC class II molecules.
Int. Immunol. 25:235-246. [ Link]